|
Toute cellule biologique est entourée d'une membrane constituée principalement d'une bicouche lipidique. Le rôle de cloisonnement de ces membranes les met au cœur de toute communication cellulaire (au sens large de "transport" d'une information d'une cellule à une autre, tel que le simple échange d'une molécule, par exemple). Pour cette fonction, la bicouche lipidique pourrait paraître biologiquement inerte et passive, car beaucoup de ces échanges sont assurées par l'intermédiaire de grosses molécules (médiateurs principalement peptidiques au sens large, en incluant les protéines), incluses dans la membrane. Il apparait en fait que le rôle de cette bicouche est vraisemblablement beaucoup plus primordial, car ses propriétés thermodynamiques et mécaniques contrôlent l'inclusion de ces médiateurs. |
Une équipe de recherche du LLB a étudié les mécanismes physiques fondamentaux à l'origine de l'inclusion de molécules dans les membranes biologiques, à travers l'exemple des peptides antimicrobiens. Ces molécules constituent la clé de voute du système immunitaire inné des organismes pluricellulaires, dont la découverte à valu le prix Nobel de médecine 2011 à l'américain B. Beutler et au français J. Hoffmann. Elles sont aujourd'hui l'objet de recherches considérables, car porteuses de beaucoup d'espoirs comme source nouvelle d'antibiotiques, mais aussi en oncologie et thérapie génique.
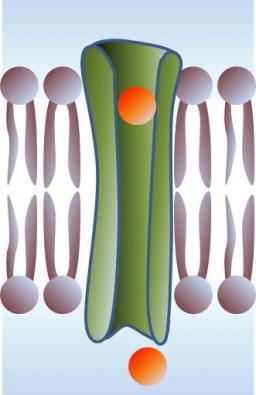
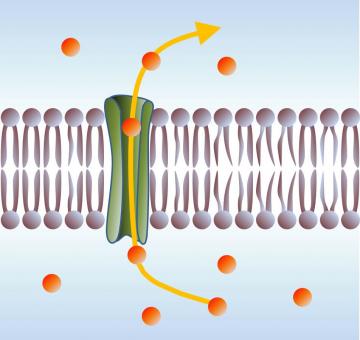
Le rôle essentiel de ces peptides est de rendre les membranes perméables, en y formant des pores. Leur présence universelle à la fois dans le règne animal et végétal, leur action non-spécifique et à large spectre, ainsi que leur structure très élémentaire laissent supposer un mode d’action selon des mécanismes physiques eux aussi très généraux et universels. Ainsi, le modèle physique du phénomène d'inclusion jusqu'ici accepté [1] est basé sur un mécanisme contrôlé par la tension mécanique de la membrane : les peptides en s'adsorbant initialement à la surface membranaire augmentent les "contraintes internes", jusqu'à un certain seuil au-delà duquel cette tension est relaxée par la pénétration du peptide dans la membrane. Les pores ainsi spontanément formées sont stables. Bien que ce modèle ait le mérite de formaliser un problème complexe, il pèche par plusieurs points : la notion de "contrainte interne" dans le cas présent reste très floue; le champ électrique transmembranaire (qui est considérable in vivo, jusqu'à 25 MV/m et est connu pour jouer un rôle dans ce problème) est ignoré; et enfin le rôle de la température, et donc de l'entropie, n'est pas précisé.
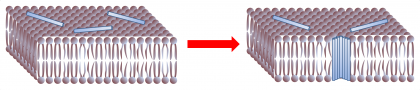
Formation d'un pore : de petits peptides s'adsorbent à la surface de la membrane. Cette position s'avère instable, et les peptides s'insérent au sein de la membrane et se rassemblent pour constituer une structure, thermodynamiquement plus favorable, constituant un pore.
Notre équipe s'est attachée à mieux comprendre et préciser ces diverses contributions : L'ouverture des pores causée par un petit peptide, l'alaméthicine, molécule emblématique, peut être observée par des mesures du courant ionique transmembranaire, en fonction de la température et de la tension électrique,. Le comportement sous champ électrique des feuillets lipidiques qui constituent la membrane a par ailleurs pu être examiné par des expériences de réflectivité de neutrons,. Les résultats originaux obtenus sont à la fois d'ordre thermodynamique, en montrant une grande perte entropique liée à l'ouverture d'un pore ; et mécanique, avec l'observation d'une déformation asymétrique des deux feuillets membranaires lorsqu'un champ électrique transverse est appliqué.
Pour rendre compte de ces observations, il a été nécessaire de reconsidérer le modèle physique existant. En particulier la présente étude précise la notion de "tension interne" : cette grandeur apparait comme directement liée à la courbure spontanée de la membrane, due soit à l'adsorption des peptides, soit au champ électrique appliqué.
Du point de vue entropique, l'ouverture d'un pore impose une "aire exclue" qui doit être considérée dans le calcul de l'entropie des lipides. En effet, lorsqu'une membrane est tendue, l'ouverture d'un pore relaxe un peu sa tension mécanique mais réduit la surface totale accessible aux mouvements de translation des lipides.
Le rôle, dans l'inclusion de molécules dans les membranes biologiques, de l'énergie libre d'adsorption et des paramètres mécaniques internes de la membrane sont ainsi précisés. Un développement intéressant à cette étude serait de mieux détailler le rôle de la tension mécanique membranaire dans l'inclusion de grosses molécules.
[1] H. W. Huang, F.-Y. Chen, and M.-T. Lee, "Molecular mechanism of peptide-induced pores in membranes", Physical Review Letters, 92:198304, 2004.
[2] "Peptide pores in lipid bilayers: Voltage facilitation pleads for a revised model",
G. C. Fadda, D. Lairez, Z. Guennouni, and A. Koutsioubas, Physical Review Letters, 111 (2013) 028102.
Contact LLB : Didier Lairez.
Collaboration :
1Laboratoire Léon Brillouin, CEA/CNRS UMR 12, CEA-Saclay, 91191 Gif-sur-Yvette, France
2Université Paris 13, UFR SMBH, 74 rue Marcel Cachin, 93017 Bobigny, France
3Institut des nanoSciences de Paris, UMR 7588, UPMC, 75005 Paris, France