De nombreuses méthodes sont développées par les équipes du NIMBE (LEDNA, LICSEN, LIONS, LSDRM) pour développer des capteurs chimiques ou biochimiques sensibles, sélectifs et efficaces. Pour ceci les nanotechnologies sont souvent utilisées avec, par exemple, l'utilisation de matériaux nanoporeux ou de nanotubes permettant un filtrage sélectif, ou encore de nano-objets présentant des propriétés spécifiques (effets plasmoniques, magnétiques...) ou pouvant être fonctionnalisés.
Les techniques de microfluidique ouvrent également des méthodes efficaces pour réaliser des capteurs à même de réaliser l'analyse dynamique de très petites quantités de liquide.
Numerous methods are developed by NIMBE teams (LEDNA, LICSEN, LIONS, LSDRM) to develop sensitive, selective and efficient chemical or biochemical sensors. Nanotechnologies are often used for this, for example, using nanoporous materials or nanotubes for selective filtering, or nano-objects with specific properties (plasmonic, magnetic effects, etc.) or which can be functionalized.
Microfluidic techniques also offer effective methods for creating sensors capable of dynamic analysis of very small quantities of liquid.
.
| Le CEA et le CNRS, et la Société CortecNet, avec le soutien de l’Agence nationale de la recherche (ANR), lancent leur laboratoire commun "Desir" (Détection efficace et sensible d'intermédiaires réactionnels par RMN). L'objectif est de développer les instruments permettant le suivi in situ de synthèses chimiques par RMN (Résonance magnétique nucléaire). Cette avancée rendue possible, grâce aux progrès de la microfluidique et de l’impression 3D, intéresse la R&D académique et industrielle en chimie. |
|
La détection de biomarqueurs dans des fluides biologiques est une étape essentielle du diagnostic de plusieurs maladies et indispensable à leur traitement. Ces biomarqueurs sont souvent présents en quantité très faible nécessitant une étape de concentration. Leur analyse s’effectue usuellement par spectrométrie de masse à partir d’un volume d’analyte déposé puis séché sur une plaque. Les phases de dépôt et d’évaporation des gouttes sont des étapes essentielles qui gouvernent la qualité, l’efficacité et la sensibilité de l’analyse. Cette méthode manque cependant d’homogénéité et de reproductibilité avec une grande variabilité sur un même dépôt ou d’un dépôt à l’autre. Dans cette perspective le laboratoire LIONS du NIMBE, en collaboration avec le Service d’Ingénierie Moléculaire des Protéines (IBiTec-S/SIMOPRO) a récemment développé un procédé DMF-MALDI (en anglais : Droplet Microfluidic-Matrix Assisted Laser Desorption Ionisation) interfaçant une puce microfluidique digitale à un spectromètre de masse MALDI-TOF (MALDI - Time of Flight). Appliqué aux peptides, ce procédé permet d’augmenter fortement leur détection et d’analyser des solutions de concentrations initiales sub-nanomolaires (< 10-9 mol/l). |
|
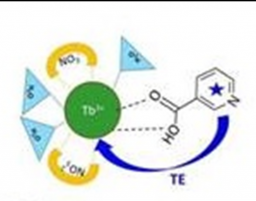
La recherche de biomarqueurs volatils en vue d’un diagnostic non-invasif de pathologies telles que le cancer ou de maladies infectieuses comme la tuberculose, est un enjeu médical majeur. Dans le cadre du projet COVADIS, l’équipe Capteurs Chimiques d’IRAMIS/NIMBE/LEDNA, en collaboration avec BioMérieux et IRAMIS/LYDIL, a exploré la possibilité de détecter un marqueur spécifique de la tuberculose active, l’acide nicotinique, présent chez les patients infectés par Mycobacterium tuberculosis. Le défi est de trouver une méthode d’analyse simple et peu coûteuse pouvant rivaliser avec la méthode d’amplification de l’ADN recommandée par l’Organisation Mondiale de la Santé, mais qui reste chère pour les pays pauvres malgré un coût négocié. La molécule-sonde choisie est un sel de lanthanide, le nitrate de terbium, Tb(NO3)3, dont la luminescence dans le domaine visible est exaltée en présence d’acide nicotinique. Ce dernier forme avec le sel de terbium un complexe stable et joue le rôle d’antenne pour absorber efficacement les photons d’excitation et transférer l’énergie d’excitation vers l’ion lanthanide qui luminesce intensément. Pour s’affranchir de l’interférence des autres métabolites présents dans le condensat d’haleine, qui diminue l’intensité de luminescence, les chercheurs exploitent la différence de volatilité entre ces interférents et l’acide nicotinique. Le piégeage des composés volatils par des éponges nanoporeuses permet de recouvrer la luminescence intense des complexes de terbium signalant la présence d’acide nicotinique. La simplicité de la méthode et son coût modique, comparé à la méthode d’amplification de l’ADN, fait de la détection de métabolites volatils une voie particulièrement prometteuse pour le diagnostic non-invasif de la tuberculose. |